Pirolo-pirimidino ir dimetilamino junginių pagrindu veikiančių gyvsidabrio ir geležies jonų jutiklių maketas
Tikslinė funkcija ir taikymų sritis:
Gyvsidabris (Hg2+) yra žinomas kaip vienas pavojingiausių sunkiųjų metalų, turintis neurotoksinį, kancerogeninį, mutageninį ir teratogeninį poveikį žmogaus organizmui. Dėl unikalių savybių gyvsidabris yra plačiai naudojamas pramonėje, todėl kartais jo patekimas į aplinką yra neišvengiamas. Gyvsidabriui patekus į vandeningą aplinką, bakterijos paverčia neorganinį gyvsidabrį į organinį, kuris gali patekti į žmonių maisto grandinę. Tuo tarpu geležies Fe2+ jonai yra plačiai paplitę žinduolių organizmuose, tačiau jos kiekį svarbu reguliuoti. Geležies trūkumas gali sukelti anemiją, diabetą ar vėžį, o jos perteklius tapti Parkinsono ar Alzhaimerio ligų priežastimi. Todėl yra labai svarbu sugebėti aptikti šiuos jonus aplinkoje ir biologiniuose mėginiuose.
Dėl šių priežasčių yra būtina kurti metalo jonų jutiklius ir nuolat gerinti jų jautrumą bei selektyvumą. Cheminiai jutikliai – tai molekuliniai receptoriai, kurie cheminę jungimosi su specifiniu analitu informaciją geba paversti matuojamu signalu. Tokie chemosensoriai yra patrauklūs dėl potencialaus lengvo detektavimo ir kiekybiško reikiamo taršos objekto nusakymo įvairiose srityse – atliekų tvarkymo, aplinkos chemijos ar klinikinės toksikologijos.
Pirolo-pirimidinai – tai heterociklinės azoto atomus turinčios sistemos, puikiai žinomos dėl savo biologinio aktyvumo ir panašumo į DNR bei RNR nukleobazes. Biologijoje labai svarbūs tokie pirimidino dariniai, kaip uracilas, timinas ir citozinas. Tai nukleorūgščių sudedamosios dalys. Pirimidino dariniai įeina į daugelio vaistų ir bioreguliatorių sudėtį. Pavyzdžiui, vitaminas B1 sudarytas iš pirimidino ir tiazolo fragmentų. Taip pat, pirimidinas yra plačiai praktikoje naudojamų migdomųjų – veronalio ir fenobarbitalio – molekulinės struktūros dalis. Visos šios savybės rodo aptartų junginių suderinamumą su biologinėmis sistemomis.
Junginiai su pirolo-pirimidino kamienu dažniausiai pasižymi efektyvia fluorescencija ultravioletinėje ir mėlynoje spektro dalyje, o fotofizikinės savybės gali būti valdomos keičiant pakaitus ar jų jungimo pozicijas. Prie šių akceptorinių darinių prijungus donorinį komponentą, įmanoma kurti fluoroforo-receptoriaus pagrindu veikiančias metalų jonų atpažinimo sistemas.
Selektyvių geležies ir gyvsidabrio jonų jutiklių schemos:
Nuolat bandoma tobulinti jutimo mechanizmus ir jutiklių selektyvumą, kad būtų galima užfiksuoti ankstyvosios taršos požymius įvairiose cheminėse sistemose – tiek gyvuose organizmuose, tiek apskritai aplinkoje. Priklausomai nuo molekulinių sistemų savybių pokyčių, jungiantis su metalų jonais, kuriami fluorescenciniai bei kolorimetriniai chemosensoriai. Fluorescenciniai katijonų jutikliai laikomi patraukliais dėl didelio jautrumo bei nesudėtingo metalų jonų aptikimo metodų. Tuo tarpu kolorimetriniai jutikliai leidžia užfiksuoti metalų jonų buvimą plika akimi, nereikalauja papildomos įrangos (pavyzdžiui, žadinančios spinduliuotės šaltinio).
1 pav. pateikiamas maketas organinio fluorescencinio jutiklio gebančio selektyviai aptikti geležies (Fe2+) bei gyvsidabrio (Hg2+) jonus pereinamųjų kadmio (Cd2+), kobalto (Co2+), vario (Cu2+), nikelio (Ni2+), švino (Pb2+), cinko (Zn2+) ar cirkonio (Zr4+) metalų fone. Jutiklis skirtas tyrimams įprastuose tirpaluose. Jonų aptikimui ruošiami bandiniai turi būti ištirpinami organiniame tirpiklyje, tam puikiai tinka tetrahidrofuranas (THF), acetonas, acetonitrilas, toluenas bei kt. Pakanka „nuplauti“ tiriamą detalės ar technologinio proceso konstrukcijos paviršių tirpikliu, pridėti jutiklio molekulių specifiškai reaguojančių su gyvsidabrio jonais ir išanalizuoti tirpalo fluorescenciją siūlomu prietaisu.
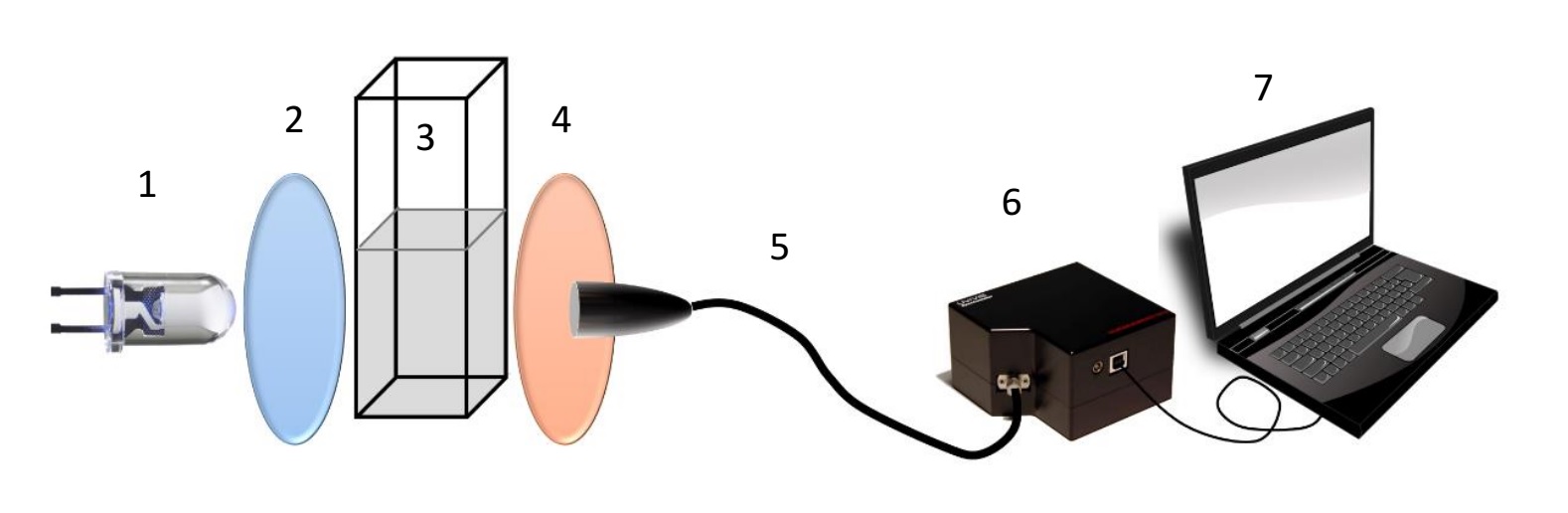
1 pav. Fluorescencinio metalų jonų jutiklio maketas. Sudedamosios dalys: 1 – UV šviestukas (350 nm); 2 – žadinimo spinduliuotę praleidžiantis filtras; 3 – kvarcinė kiuvetė su tiriamuoju tirpalu; 4 – filtras, blokuojantis žadinimo spinduliuotę bei praleidžiantis fluorescenciją; 5 – šviesolaidis; 6 –mini CCD spektrometras; 7 – nešiojamasis kompiuteris.
Bandinys kvarcinėje kiuvetėje sumaišomas su jutiklio molekulėmis tirpiklyje ir patalpinamas į matavimo sistemą (1 pav. pažymėta 3). Bandinys sužadinamas UV šviesa (350 nm) skleidžiančiu diodu (1), o žemos energijos bangų filtras (2) užtikrina, jog bandinio nepasiekia pašalinė šviesa. Kitas aukštos energijos bangų filtras (4) nufiltruoja žadinančiąją šviestuko spinduliuotę ir užtikrina, jog į šviesolaidį (5) patenka tik bandinio fluorescencija. Ji šviesolaidžiu keliauja iki mini CCD spektrometro (6), kuris užregistruoja bandinio spektrą ir duomenis perduodą į kompiuterį (7). Kompiuteryje programine įranga atlikus spektro analizę galime selektyviai ir jautriai atpažinti geležies (Fe2+) bei gyvsidabrio (Hg2+) jonus. Šis fluorescencinis jutiklis geba aptikti jonus, kurių koncentracija tesiekia ~1nmol/l. Kuriant jutiklio prototipą galima ženkliai atpiginti detekcijos schemą ir supaprastinti jutimo procedūras, optimizuojant jutiklio kainos ir funkcijos savybes.
Jutiklio veikimo principas:
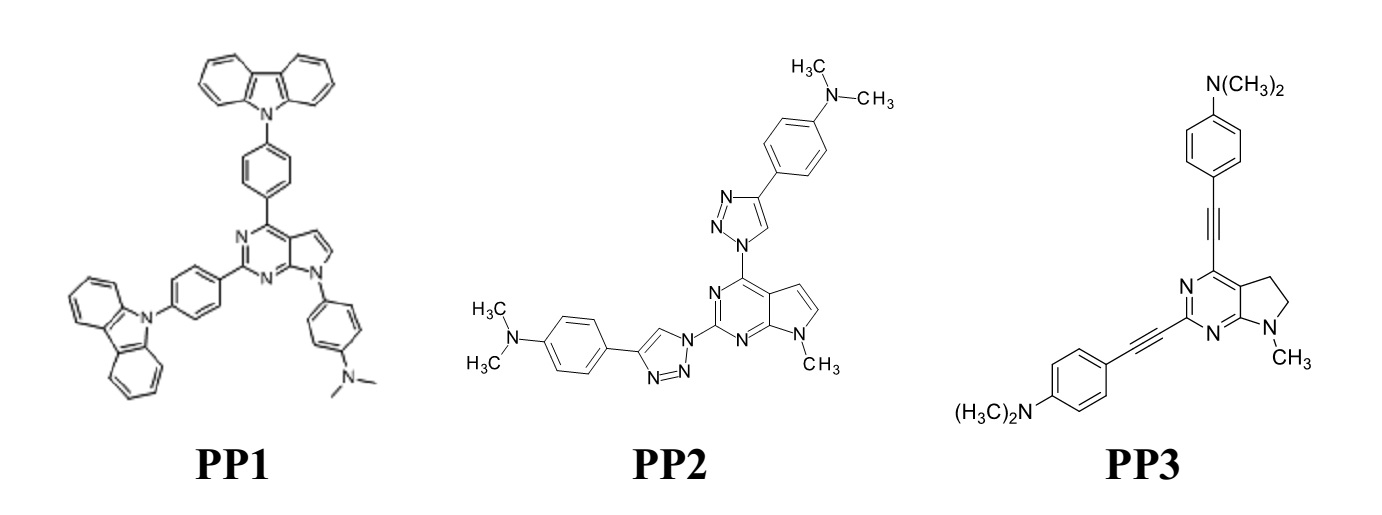
Metalų jonų detektoriaus veikimo principas yra grindžiamas organinių pirolo-pirimidino (PP1, PP2, PP3) darinių neįprastomis fotofizikinėmis savybėmis. Molekulių struktūros pateiktos 2 pav. Junginio PP1 kamieną sudaro pirolo-pirimidino žiedas, fenil-karbazolai prijungti prie pirimidino 2 ir 4 pozicijų, o fenil-dimetilaminas – prie pirolo azoto. Junginys PP2 turi du triazolo žiedus prie jų prijungtus fenil-dimetilaminus. Molekulėje PP3 triazolai yra pakeisti trigubomis jungtimis. Šie dariniai išsiskiria lokalių (LE) ir krūvio pernašos (TICT) būsenų formavimu, kurios yra ryškiai atskirtos spektre bei specifine sąveika su gyvsidabrio ir geležies jonais. Organinių molekulių ir metalų jonų kompleksacija pasireiškė skirtingais būdais – fluorescencijos stiprinimu bei gesinimu, naujos fluorecencijos juostos susiformavimu bei sugerties spektrų raudonuoju poslinkiu. Toliau apžvelgsime keletą metalų jonų atpažinimo mechanizmų, veikiančių pirolo-pirimidino junginių pagrindu.
2 pav. Pirolo-pirimidino dariniai
Šiame apraše yra siūlomos 3 metalų jonų jutiklių schemos:
1. Fluorescencijos stiprinimo metalų jonų atpažinimas.
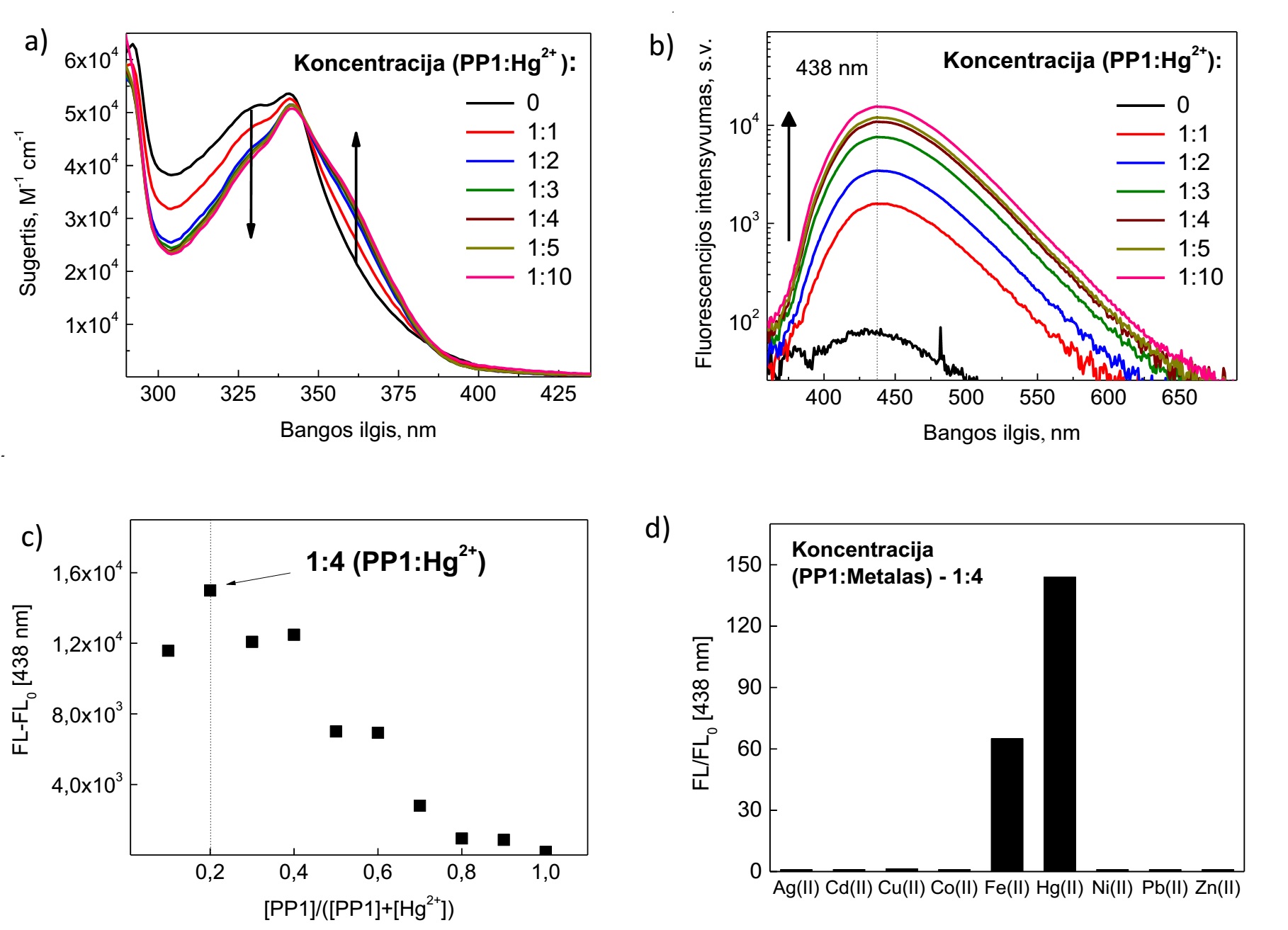
Junginys PP1 pasižymi ypač silpna fluorescencija, kurią nulemia dėl susisukusios vidumolekulinės krūvio pernašos būsenų (sutrumpintai vadinamų TICT) vykstantis spartus sužadinimo nespindulinis gesimas. Įdomu tai, jog junginio PP1 tirpale gyvsidabrio jonai geba formuoti kompleksus su molekulėmis ir pastebimai keisti optines savybes. 3 pav., a). paveiksle pavaizduoti junginio sugerties spektrai, esant skirtingoms gyvsidabrio druskų tirpalo koncentracijoms. Sugerties spektrai kinta nežymiai, nematyti spalvinių bandinių pokyčių, tačiau didinant gyvsidabrio koncentraciją bendrame tirpale, sugerties spektro juostos ties 330 nm intensyvumas mažėja, o ties 355 nm – auga.
Ryškesnis optinių savybių atsakas į gyvsidabrį buvo stebimas fluorescencijos spektruose (3 pav., b)). Net prie mažiausių gyvsidabrio koncentracijų, kai medžiagos ir metalų jonų santykis lygus 1, fluorescencijos intensyvumas išauga apie 20 kartų. Metalų druskų koncentracijai PP1 koncentraciją viršijus 10 kartų, fluorescencijos intensyvumo maksimali vertė padidėja apie 190 kartų ir toliau auga, didinant metalų jonų koncentraciją. Taigi, pastarasis jutimo mechanizmas pasireiškė fluorescencijos juostos ties 438 nm išaugimu. Job‘s Plot metodo pagalba (3 pav., c)) nustatyta, kad efektyviausiai medžiagos ir metalų jonų kompleksas formuojasi, esant santykiui 1:4 (prie vienos PP1 molekulės jungiasi keturi gyvsidabrio jonai).
3 pav. Fotofizikinės PP2 darinio savybės nesant ir esant pereinamųjų metalų sistemoje. (a) PP1 sugerties spektrai; (b) fluorescencijos spektrai; (c) Džobo grafikas PP1 darinio ir gyvsidabrio jonų kompleksacijos santykiui nustatyti; (d) Jutiklio atsako signalas į įvairius pereinamųjų metalų jonus.
Jau minėta, jog PP1 molekulė THF tirpiklyje yra jautri ir geležies jonams. Tačiau šiuo atveju fluorescencijos intensyvumo išaugimas mažesnis. PP1 selektyvumas įvairiems metalams pavaizduotas 3 pav., d). Bandiniai buvo tiriami, kai metalų jonų koncentracija viršijo junginio koncentraciją keturis kartus. Matyti, jog junginys yra selektyvus tik Hg2+ ir Fe2+ jonams, o fluorescencijos intensyvumo atsakas į gyvsidabrį yra apie du kartus stipresnis nei į geležį ir 150 kartų stipresnis lyginant su kitais metalais.
2. Spalvinis fluorescencinis metalų jonų jutimas.
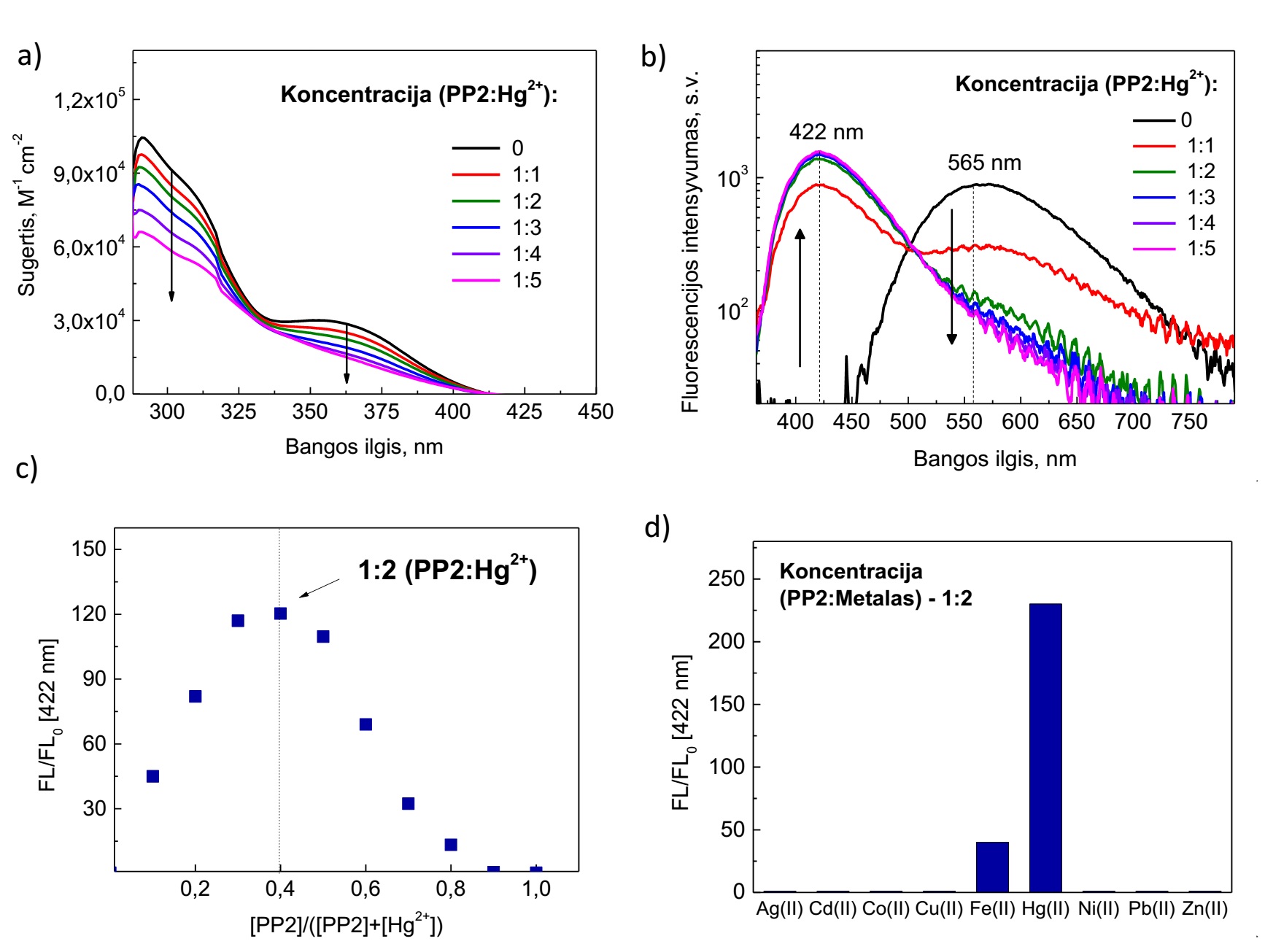
Junginys PP2 pasižymi spalviniu fluorescencijos pokyčiu, kai į medžiagos tirpalą patenka gyvsidabrio jonų. Šių medžiagų bemetalė fluorescencijos spektro juosta yra išplitusi ir bestruktūrė (4 pav., b)), o intensyviausios vertės yra ties 570-580 nm. Stipri elektronų donorinė dimetilamino grupė lemia vidumolekulinės krūvio pernašos (TICT) būseną ir gesina fluorescenciją. Tačiau į junginių tirpalus pridėjus gyvsidabrio jonų, situacija pakinta. Didėjant Hg2+ koncentracijai, PP2 junginyje juosta ties 570 nm gęsta ir susiformuoja nauja fluorecencijos spektro juosta ties 422 nm, kuri auga kartu su didėjančia Hg2+ koncentracija bendroje sistemoje (4 pav., b)).
4 pav. Fotofizikinės PP2 darinio savybės nesant ir esant pereinamųjų metalų sistemoje. (a) PP2 sugerties spektrai; (b) fluorescencijos spektrai; (c) Džobo grafikas PP2 darinio ir gyvsidabrio jonų kompleksacijos santykiui nustatyti; (d) Jutiklio atsako signalas į įvairius pereinamųjų metalų jonus.
Sugerties spektruose pokyčiai nėra tokie ryškūs – PP2 sugerties molinis ekstinkcijos koeficientas mažėja, didėjant Hg2+ koncentracijai, o sugerties spektro forma tampa plokštesnė (4 pav., a)). Atlikus kompleksų stechiometrijos tyrimą PP2 junginiui, Džobo diagramoje (4 pav., c)) stebima intensyviausia vertė nurodo, jog prie vienos PP2 molekulės jungiasi 2 metalų jonai. Medžiagų selektyvumas įvairių metalų jonų fone pavaizduotas 4 pav., d). Kaip ir PP1 junginio tyrimų atveju, buvo užfiksuotas jautrumas geležies jonams, kurių įtaka PP2 medžiagos optinių savybių pokyčiui yra mažesnė nei gyvsidabrio jonų įtaka. Nebuvo užfiksuotas jautrumas kitiems išbandytiems metalų jonams.
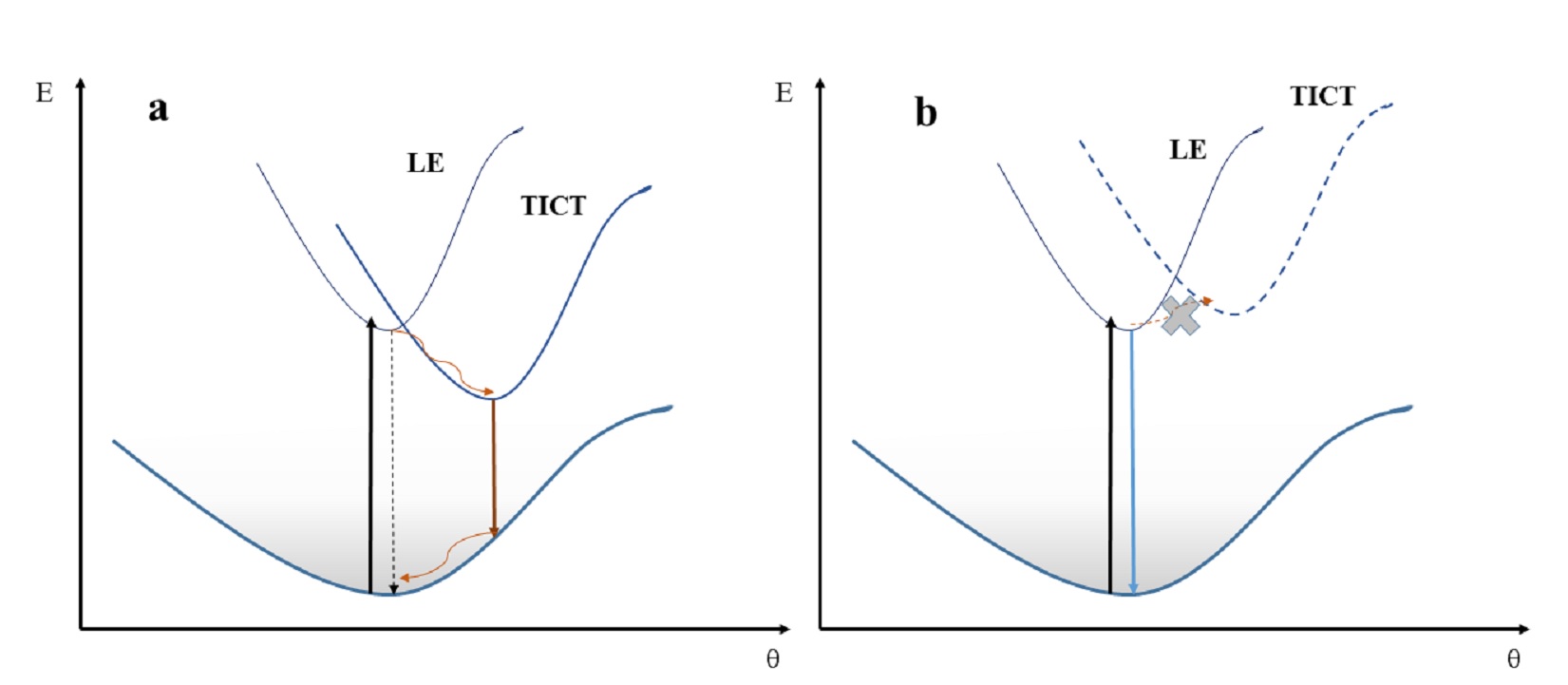
TICT ir LE būsenų kaitos nulemtas metalų jonų atpažinimas. Molekulių PP1, PP2 selektyvumas gyvsidabrio ir geležies jonams bei jutimo mechanizmai yra labai panašūs – stebimas lokaliosios būsenos (LE) (5 pav, a), b)) ties mažesniais bangos ilgiais fluorescencijos juostos intensyvumo išaugimas. Tokį vyksmą galima sieti su susisukusios vidumolekulinės krūvio pernašos būsenos (TICT) relaksacija. PP2 fluorescencijos spektruose be metalų stebima ilgabangė TICT fluorescencijos juosta ties 570-580 nm priskiriama tokiai molekulės konformacijai, kai sužadintoje būsenoje dimetilamino fragmentas yra pasisukęs. Pastaroji būsena nulemia išaugusią nespindulinę rekombinaciją, todėl molekulės šviečia prastai. Tačiau, kai junginiai suformuoja kompleksus su metalo jonais, pastarieji apriboja dimetilamino fragmento sąsuką. Todėl molekulių konfigūracija tampa plokštesnė ir jai būdinga LE juosta mėlynesnėje spektro dalyje (ties 420-450 nm) ima pastebimai augti kartu su didėjančia metalų jonų koncentracija. Laikome, jog ir PP1 atveju be metalų pasireiškia būdinga TICT būsena, tačiau jos fluorescencijos intensyvumas yra itin mažas ir jo nepavyksta užfiksuoti.
5 pav. Junginių potencialiniai paviršiai susisukusioje vidinės krūvio pernašos būsenoje (TICT) ir lokaliai sužadintoje (LE) be metalų jonų (a) ir su metalų jonais (b).
3. Kolorimetrinis metalų jonų jutimas.
Visiškai priešingu efektu nei pastarieji pasižymi PP3 molekulė. Šioje medžiagoje dimetilamino fragmentai yra sujungti trigubomis jungtimis ir tokia molekulės struktūra drastiškai keičia jos savybes bei jautrumą metalų jonams. Triguba jungtis riboja dimetilamino fragmentų sąsuką, todėl sužadinus šią molekulę matoma LE fluorescencija, kurios kvantinis našumas siekia 21%, o fluorescencijos intensyviausia vertė yra ties 488 nm. Kaip ir anksčiau aptartuose atvejuose, selektyvumas stebėtas gyvsidabrio ir geležies jonams. Tačiau PP3 molekulės atveju gyvsidabrio ir geležies jonai pastebimai užgesina junginio fluorescencija jau prie mažiausių koncentracijų, kai koncentracijų santykis yra lygus (6 pav., b) ).
Įdomiausi efektai kartu su metalų jonais stebimi sugertyje. Kaip matyti 6 a) paveiksle, kai į sistemą patenka gyvsidabrio jonų, sugerties spektras kardinaliai pasikeičia – sugerties juosta ties 368 nm užgęsta, susiformuoja du nauji sugerties spektro maksimumai ties 404 nm ir 465 nm, kurie persikloja su PP3 fluorescencijos spektru. Toks sugerties spektro pokytis nulemia ir akimi matomą bandinio spalvos pokytį – bandinys su gyvsidabrio ir geležies jonais tampa gelsvas.
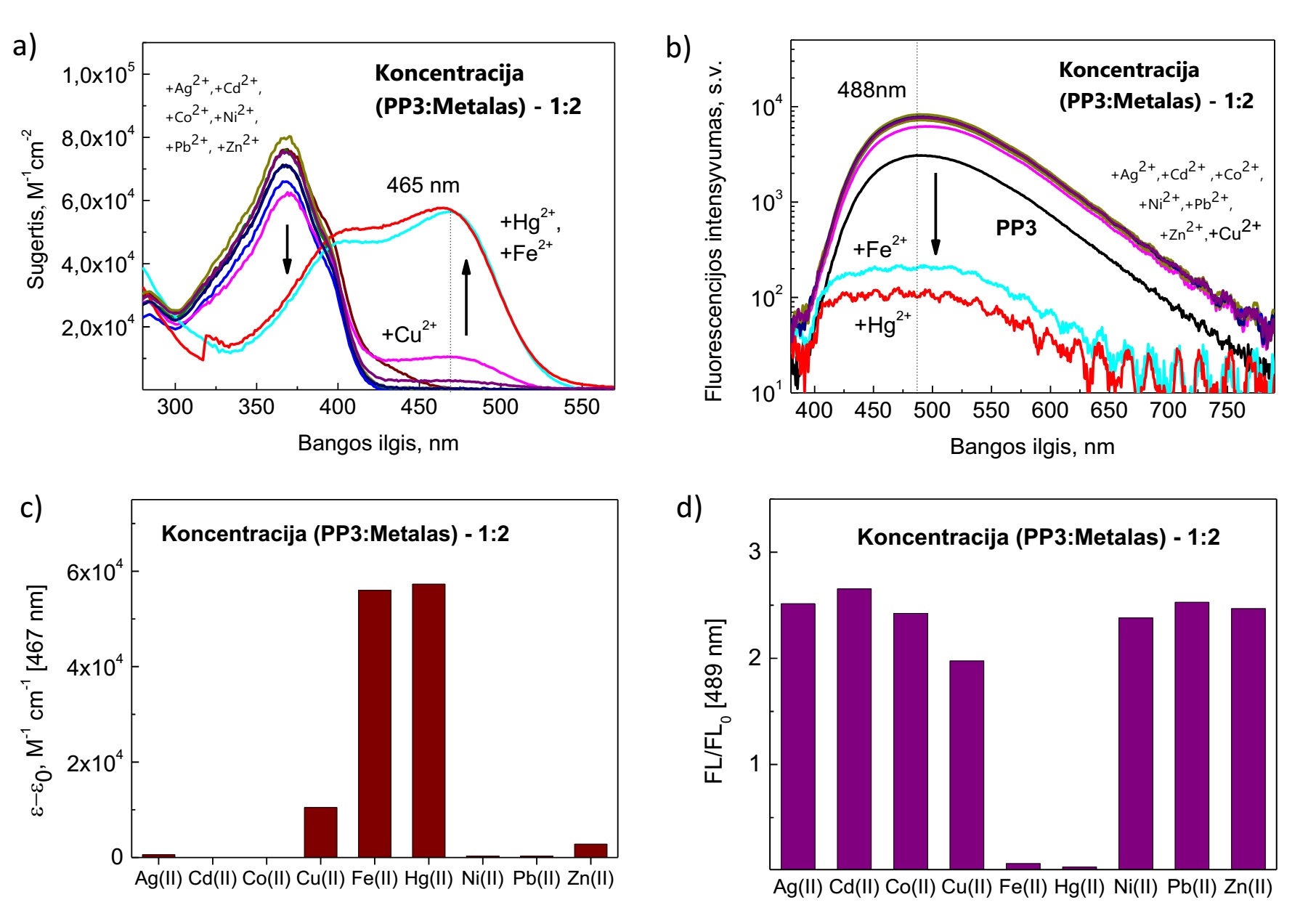
6 pav. Fotofizikinės PP3 darinio savybės nesant ir esant pereinamųjų metalų sistemoje. (a) PP3 sugerties spektrai; (b) fluorescencijos spektrai; (c) Junginio PP3 sugerties molinio ekstinkcijos koeficiento pokytį iliustruojanti stulpelinė diagrama esant įvairiems metalų jonams; (d) Fluorescencijos intensyvumo santykinį pokytį iliustruojanti stulpelinė diagrama.
Junginio PP3 ir Hg2+ kompleksų stechiometrijai nustatyti buvo fiksuojamas sugerties molinio ekstinkcijos koeficiento pokytis (6 pav., c)). Pagal Job’s Plot metodą atlikus matavimus, buvo pastebėta, kad susilyginus PP3 ir Hg2+ koncentracijoms, toliau nebestebimas sugerties molinio ekstinkcijos koeficiento pokyčio žymus augimas ar mažėjimas. Vadinasi, tiriamasis junginys su gyvsidabrio jonais geba lengvai formuoti stabilius kompleksus jau nesužadintoje būsenoje. Fluorescencijos ir sugerties tyrimai (6 pav., c) – d)) kitų metalų fone rodo, jog didžiausias PP3 selektyvumas išlieka gyvsidabrio ir geležies jonams.
7 pav. Vizualiniai spalviniai bandinių pokyčiai: (a) Junginio PP2 fluorescencijos spalvininiai pokyčiai be metalų (kairėje) ir su gyvsidabrio jonais (dešinėje); (b) Junginio PP3 sugerties pokyčiai su metalų jonais. Iš kairės į dešinę išrikiuoti bandiniai: PP3, PP3+Cu2+, PP3+Fe2+, PP3+Hg2+.
Vizualiniai fluorescencijos ir sugerties pokyčiai PP2 ir PP3 junginiams vaizduojami 7 a), b) paveiksluose. Matomas visų junginių selektyvus jautrumas gyvsidabrio bei geležies metalų jonams tiek naudojant tiek fluorescencinius, tiek kolorimetrinius jutimo metodus. Svarbu paminėti, jog šios sistemos yra aktyvios vandens terpėje.